МЕЛИССОПАЛИНОЛОГИЯ
Задачи мелиссопалинологии
Объекты мелиссопалинологического анализа
Методы мелиссопалинологического анализа:
Подготовка контрольных микропрепаратов пыльцы растений
- Приготовление микропрепаратов из свежей пыльцы
- Приготовление микропрепаратов из пыльцы гербарных образцов
- Приготовление глицерин-желатины
Качественный пыльцевой анализ обножки и перги
- Приготовление микропрепаратов из обножки и перги
- Подсчёт пыльцы в микропрепаратах
- Интерпретация результатов
Количественный пыльцевой анализ обножки
- Отбор обножек для анализа
- Приготовление микропрепаратов из обножки и подсчёт пыльцы
- Расчёт и интерпретация результатов
Качественный пыльцевой анализ мёда
- Приготовление микропрепаратов из мёда
- Подсчёт пыльцевых зёрен и представление результатов
- Интерпретация результатов
- Повторность опытов
Количественный пыльцевой анализ мёда
- Подготовка микропрепаратов из мёда
- Подсчёт пыльцевых зёрен
- Расчёт, представление и интерпретация результатов
_________________________________________________________________________________________________________________________________________
Задачи мелиссопалинологии
Перед мелиссопалинологическим анализом ставятся следующие задачи: выявление качественного и количественного состава пыльцы в продуктах пчеловодства (обножке, перге, ульевом и бортевом мёде), установление медоносно-перганосной базы региона, идентификация ботанического и географического происхождения медов и других продуктов пчеловодства, и выявление случаев их фальсификации.
Текущее состояние знаний мелиссопалинологической системы позволяет достоверно диагностировать ботаническое и географическое происхождение мёда и других продуктов пчеловодства. Мелиссопалинологический метод анализа может быть усовершенствован путем учреждения национальных и международных стандартов [Piana, 2007]. В связи с этим в 1990 году под эгидой Апимондии (Международной федерации пчеловодных объединений) была создана Международная комиссия по вопросам мёда (IHC), целями которой являются совершенствование методов анализа мёда и введение новых критериев качества [Oddo, Bogdanov, 2004]. В результате работы комиссии выделено 15 основных сортов европейских монофлорных медов [Oddo, 2004a]. Полученные данные были использованы при ревизии мирового стандарта на мёд в Codex Alimentarius [Rev. Cod. Stand. honey, 2001]. В России на сегодняшний день ГОСТом Р 52451-2005 «Мёд монофлорный. Технические условия» регламентирована характеристика лишь 3 сортов монофлорных медов: гречишного, липового и подсолнечникового.
Объекты мелиссопалинологического анализа
Рацион пчёл состоит из нектара и пыльцы растений. Нектар – это углеводный корм, а пыльца представляет собой главный источник белка и имеет большое значение для развития тканей и желёз пчелы [Темнов, 1967; Драчёв, 1991; Haydak, 1970; Stanley, 1974; Dietz, 1978; Keller, 2005].
Для сбора и транспортировки пыльцы у рабочей пчелы имеются особые приспособления на задних ножках (корзиночки), куда пчела собирает пыльцу в виде комочков разного цвета, которые называют обножками [Коваленко, 1966; Фриш, 1980; Таранов, 1972, 1986; Васильева, Халифман, 1981; Рут, 1993; Кайяс, 1998]. В состав одной средней обножки входит около 100 тыс. пылинок [Глухов, 1955] (рис. 65).
 |
Рис. 65. Фото образцов обножек, собранных на пасеках заповедника «Шульган-Таш», и их пыльцевой состав (фото Р.Г. Курманова) |
Обножка сбрасывается в виде двух рыхлых комочков на дно ячейки сота, в которой уже выводились молодые пчёлы. Еще при сборе пыльцы пчёлы смачивают обножку слюной, а, укладывая в ячейки сотов, заливают мёдом. Обработанные таким образом обножки в сотах подвергаются молочно-кислому брожению, полученный при этом продукт называется пергой [Глухов, 1955; Виноградов, 1966; Дмитриева, 2005] (рис. 66). Цвет пылинок при этом несколько меняется: они становятся прозрачнее, с более резким выступлением деталей от консервирующего и просветляющего действия мёда. Поэтому, в отличие от обножки, пыльцу в перге невозможно различить по цвету [Dimou, Thrasyvoulou, 2007].
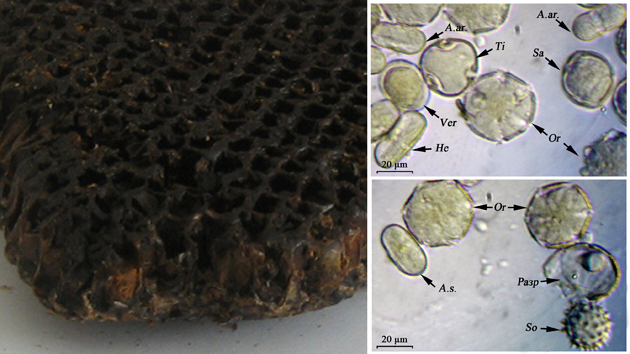 |
Рис. 66. Соты с бортевой пергой и фото пыльцы в микропрепаратах из бортевой перги (фото Р.Г. Курманова)
|
Собирая с растений нектар, пчёлы переносят его в улей и перерабатывают нектар в мёд [Виноградов, 1962; Таранов, 1972; Иойриш, 1974]. В каждом натуральном мёде в том или ином количестве содержатся пыльцевые зёрна (рис. 67). В мёд пыльца попадает вместе с нектаром.
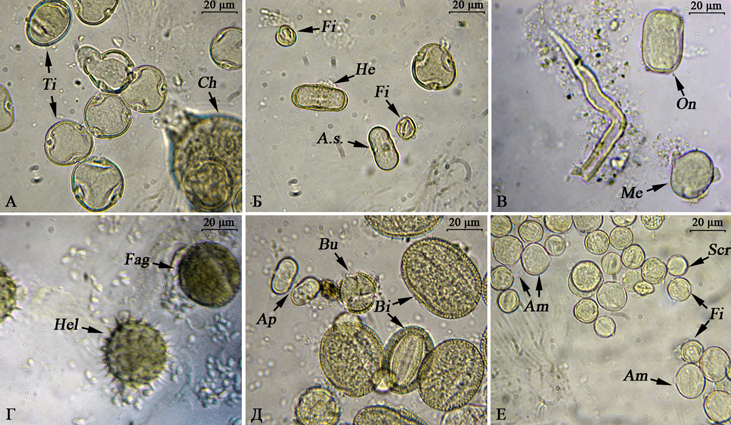 |
Рис. 67. Фото пыльцы в микропрепаратах ульевого (А-Г) и бортевого мёда (Д, Е) (фото Р.Г. Курманова)
|
Кроме обножки, перги и мёда пыльца может содержаться в составе маточного молочка. Результаты пыльцевого анализа данного продукта дают общую информацию о качестве питания пчёл и медоносно-перганосной флоре региона. Однако данный анализ довольно трудоёмок, в связи с низкой представленностью пыльцевых зёрен в составе маточного молочка и низкой степенью их сохранности [Dimou, 2008].
Также довольно часто используется пыльцевой анализ содержимого кишечника пчёл. Данный метод применяется в основном в тех случаях, когда пыльцевой анализ других продуктов пчеловодства невозможен, или когда необходимо провести быструю качественную оценку основных источников нектара и пыльцы [Полевова, Билаш, 2005; Dimou & Thrasyvoulou, 2006; Dimou, 2008].
Данные пыльцевого анализа свидетельствуют о том, что, несмотря на большое разнообразие цветущих растений, в качестве основных источников нектара и пыльцы используются немногие [Белкова, 1973]. Растения, посещаемые пчёлами для сбора нектара или пыльцы (или того и другого), можно разделить на 4 группы [Губин, 1941]:
- медоносные (нектароносные) – растения, с которых пчёлы берут только нектар;
- нектароносно-перганосные – растения, с которых пчёлы берут главным образом нектар и в меньшей степени пыльцу;
- перганосно-нектароносные – растения, с которых пчёлы берут главным образом пыльцу и в меньшей степени нектар;
- перганосные (пыльценосные) – растения, с которых пчёлы собирают только пыльцу.
Выделение двух промежуточных групп на практике оказывается довольно сложным, поэтому рекомендуется объединять их в одну группу медоносно-перганосных (нектароносно-пыльценосных) видов растений [Курманов, 2010].
Группа перганосных растений включает:
- - энтомофильные виды, которые не продуцируют нектар: виды сем. Hypericaceae (зверобойные), Papaveraceae (маковые), Ranunculaceae (лютиковые): Adonis (адонис), Anemone (ветреница), Anemonoides (ветреничка); Rosaceae (розоцветные): Rosa (роза), Agrimonia (репейничек); Asteraceae (сложноцветные): Artemisia (полынь), Ambrosia (амброзия) (рис. 68). Статус видов рода Filipendula и сем. Cistaceae, указываемых как медоносные [Кучеров, 1998] сомнителен, так как они в целом продуцируют небольшое количество нектара;
- анемофильные (ветроопыляемые) виды: виды родов Quercus (дуб), Fagus (бук), Betula, Alnus, Carpinus (граб), Corylus (лещина), Pinus, Abies (пихта), Picea , Larix , Thalictrum , сем. Poaceae (злаки), Chenopodiaceae (маревые), Plantaginaceae (подорожниковые), Carex (осока), Rumex (щавель), Cannabis (конопля), Humulus (хмель), Amaranthus (щирица), Urtica (крапива), Typha (рогоз) [Maurizio, 1970; Frank, Klotz, 1990; Ишемгулов, Бурмистров, 2008] (рис. 69). Виды данной подгруппы имеют высокие показатели пыльцевой продуктивности и дальности разноса пыльцы, поэтому низкая представленность (< 3%) их пыльцы в продуктах пчеловодства может свидетельствовать лишь о случайном заносе.
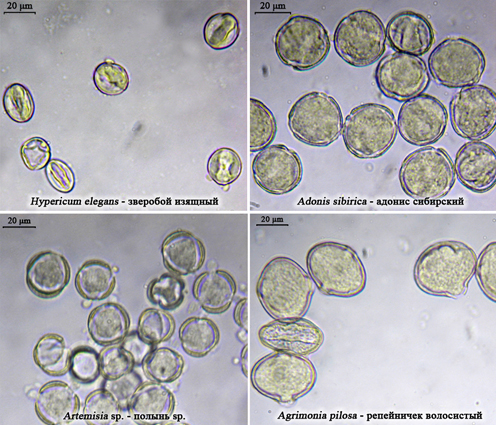 |
Рис. 68. Фото пыльцы некоторых энтомофильных видов растений, не продуцирующих нектар, домини- рующих в микропрепаратах обножек (фото Р.Г. Курманова) |
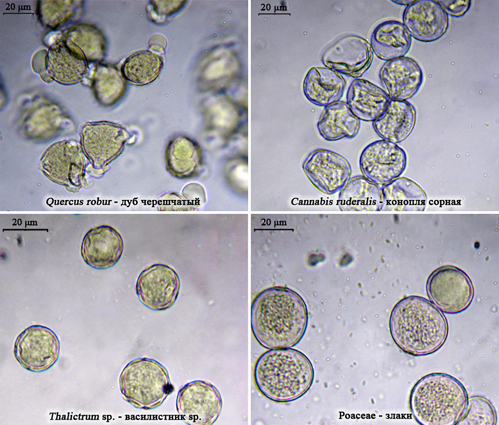 |
Рис. 69. Фото пыльцы анемофильных видов растений, в микропрепаратах обножек, являющихся перга- носами (фото Р.Г. Курманова) |
Методы мелиссопалинологического анализа
Подготовка контрольных микропрепаратов пыльцы растений
Коллекция микропрепаратов пыльцы растений является незаменимым дополнением к опубликованным атласам пыльцы.
Приготовление микропрепаратов из свежей пыльцы. Пыльник из нераскрывшегося пыльника помещают на предметное стекло. Разрушают оболочку пыльника и отделяют из него пыльцевые зёрна, на которые наносят каплю дистиллированной воды. После некоторого подсыхания пыльцу фиксируют каплей 76%-ного спирта, слабо окрашенного фуксином. Появившееся на стекле жирное кольцо снимают ватным тампоном, смоченным спиртом. Затем препарат сразу же заливают каплей разогретой глицерин-желатины и накрывают покровным стеклом. Через 3-4 дня края покровного стекла окантовывают парафином или канадским бальзамом.
Приготовление микропрепаратов из пыльцы гербарных образцов. Пыльник помещают на предметное стекло и на него наносят 2-3 капли 96%-ного спирта, после чего добавляют 2-3 капли дистиллированной воды и подогревают стекло до полного исчезновения влаги. Затем препаровальной иглой разрушают оболочку пыльника, а пыльцевые зёрна фиксируют 2-3 каплями 96%-ного спирта, слабо окрашенного фуксином. На препарат наносят глицерин-желатину, накрывают его покровным стеклом, излишки глицерин-желатины убирают с помощью фильтровальной бумаги. Затем препарат сушат в течение 3-4 дней. После сушки препарат осторожно вытирают тряпкой, смоченной в спирте. Края покровного стекла окантовывают парафином или канадским бальзамом [Бурмистров, Никитина, 1990].
Приготовление глицерин-желатины. 1 г желатины и 6 мл дистиллированной воды вносят в небольшую колбу. Желатина набухает несколько часов, и после этого в колбу добавляют 7 мл очищенного глицерина и кристаллик антисептика. Колбу переносят на горячую водяную баню. Через некоторое время смесь в колбе разжижается. Её переносят в термостат и фильтруют через бумажный фильтр в горячем виде. Глицерин-желатина долго хранится в закрытой стеклянной склянке с корковой пробкой. При необходимости склянку помещают в воду, подогреваемую на водяной бане [Мейер-Меликян, 1999].
Качественный пыльцевой анализ обножки и перги
Приготовление микропрепаратов из обножки и перги. Обножку помещают в чашку Петри, заливают дистиллированной водой и после полного размягчения (20-30 минут), жидкость сливают, из осадка делают мазок на чистом предметном стекле. После некоторого подсыхания пыльцу фиксируют каплей 76%-ного спирта, слабо окрашенного фуксином. Появившееся жирное кольцо снимают ватным тампоном, который предварительно смачивают в спирте. Затем препарат сразу же заливают каплей разогретой глицерин-желатины и накрывают покровным стеклом, придерживая его с одного конца препаровальной иглой. Через 3-4 дня края покровного стекла окантовывают парафином.
Пергу, извлечённую из 15 ячеек с разных участков сота, помещают в чашку Петри, заливают дистиллированной водой и выдерживают в течение 3 часов до полного размягчения. После перемешивания стеклянной палочкой, жидкость сливают, из осадка делают мазок на предметном стекле. Дальнейшие операции по приготовлению микропрепарата проводят по описанной выше схеме [Бурмистров, Никитина, 1990].
Подсчёт пыльцы в микропрепаратах. Первоначально в микропрепарате идентифицируют все виды пыльцевых зёрен. В случаях, когда определение пыльцы до вида или рода невозможно, используют общие категории, такие как группа, форма и тип. Затем проводят подсчёт пыльцевых зёрен в 5 параллельных трансектах. Для расчета процентного соотношения видового состава пыльцы в микропрепаратах достаточно подсчитать не менее 300 пыльцевых зёрен [Dimou, Thrasyvoulou, 2007b].
Интерпретация результатов. Ботаническое происхождение обножки и перги устанавливают по доминирующей пыльце. Достоверное определение географического происхождения возможно лишь при идентификации всех встреченных видов пыльцевых зёрен. Результаты анализа перги и обножек, отобранных за весь сезон, позволяют составить список перганосной флоры региона.
Количественный пыльцевой анализ обножки
Отбор обножек для анализа. Отбор обножек проводят с помощью пыльцесборника в течение всего сезона: с ранневесеннего периода (с момента выставки ульев из зимовника) до поздней осени (до момента уборки пчёл обратно в зимовник). Обножки из пыльцесборника извлекают через каждые три дня. После чего их очищают от мусора, сушат при комнатной температуре и взвешивают. От обножек каждого сбора отделяют 1/10 часть и сортируют обножки по цвету. Во всех выделенных цветовых группах изучают пыльцевой состав, анализируя при этом как минимум два схожих по цвету экземпляра обножки.
Приготовление микропрепаратов из обножки и подсчёт пыльцы проводят по описанной выше схеме.
Расчёт и интерпретация результатов. После качественного анализа пыльцевого состава обножек, каждую цветовую группу взвешивают и по полученным результатам оценивают общее количество пыльцы, собранное пчёлами с перганосных и перганосно-медоносных видов растений [Dimou, 2008].
Качественный пыльцевой анализ мёда
Приготовление микропрепаратов из мёда. Навеску мёда 10 г заливают 20 мл холодной дистиллированной воды (20-40 С) и ставят на водяную баню (+45 С) до полного растворения мёда. Полученный раствор центрифугируют в течение 10 мин со скоростью 2500-3000 об/мин. После надосадочную жидкость сливают, а осадок проволочной петлёй переносят на предметное стекло и равномерно распределяют на площади 20х20 мм. После подсыхания (желательно подогреть стекло до полного исчезновения влаги) осадок фиксируют 96%-ным раствором спирта, окрашенным фуксином, и заливают каплей разогретой глицерин-желатины.
Подсчёт пыльцевых зёрен и представление результатов. Первоначально в микропрепарате идентифицируют все виды пыльцевых зёрен, затем проводят их подсчет в 5 параллельных трансектах. Расстояние между трансектами рассчитывают на основе плотности пыльцевых зёрен в микропрепарате и размера поля зрения.
Для установления классов частот достаточно подсчитать не менее 300 пыльцевых зёрен. Для расчета точного процентного соотношения пыльцевого состава в микропрепарате необходимо подсчитать от 500 до 1000 пыльцевых зёрен. Подсчет разрушенной и недоразвитой пыльцы ведут в том случае, если она может быть идентифицирована. Если осадок содержит высокий процент перепредставленной пыльцы, например, пыльцу Myosotis spp. (незабудка spp.), то рекомендуется провести повторный анализ, исключив из расчетов пыльцу данного вида. Падевые элементы (споры и гифы грибов, микроскопические водоросли) подсчитывают отдельно. Также отдельно отмечают наличие в микропрепарате гранулированного микрокристаллического осадка, дрожжей, частиц пыли, капель жира, крахмала и растительных частиц.
При представлении классов частот пыльцевых зёрен используют следующие обозначения: «очень часто», если доля пыльцы превышает 45%; «часто» – 16-45%; «редко» – 3-16 %; «спорадически» – менее 3%. При представлении процентного содержания пыльцевых зёрен используют обозначения: преобладающая пыльца > 45 %, вторичная пыльца 16-45 %, важная сопутствующая пыльца 3-16 %, сопутствующая пыльца < 3 %.
При представлении частот падевых элементов используют следующие обозначения: практически отсутствуют (HDE/PG = 0,00-0,09, где HDE – частота падевых элементов, PG – общая частота пыльцевых зёрен медоносных растений), немногочисленные (0,10-1,49), среднее количество (1,50-2,99), многочисленные (3,00-4,49), очень многочисленные (> 4,50).
Интерпретация результатов. Определение ботанического происхождения основано на расчёте относительной частоты пыльцы медоносных видов растений. Мёд считается монофлорным, если относительная частота пыльцы одного вида превышает 45 %. Исключением являются меда, собранные с растений с пере- и недопредставленной пыльцой (табл. 3).
Содержание доминирующей пыльцы в российских монофлорных медах равно 45 % для подсолнечникового, 30 % – для липового и гречишного сортов мёда [ГОСТ Р 52451-2005. «Мёд монофлорный. Технические условия»].
Таблица 3 |
Содержание пыльцы в некоторых монофлорных медах Европы
| Недопредставленная пыльца |
Недопредставленная лишь в некоторых случаях пыльца |
Нормально представленная пыльца |
Перепредставленная пыльца |
| Carduus (5–25 %) |
Helianthus (12–92 %) |
Erica (> 45%) |
Castanea (> 86 %) |
| Citrus (2–42 %) |
Robinia (7–60 %) |
Hedysarum (> 50%) |
Eucalyptus (> 83 %) |
| Medicago (1–10 %) |
Thymus (13–68 %) |
|
Brassica napus (> 60 %) |
| Taraxacum (5–40 %) |
Tilia (1–56 %) |
|
Phacelia (> 60 %) |
Падевым мёд является, если соотношение количества падевых элементов и пыльцы превышает 3.
Географическое происхождение может быть установлено по наличию в пыльцевых спектрах мёда пыльцы растений, имеющих конкретные ареалы. При этом административные границы региона не всегда соответствуют областям распространения данных видов. Чаще всего регион, в котором был собран мёд, определяется по определенной комбинации пыльцы [Maurizio, 1970; Von der Ohe, 2004].
Повторность опытов. П. Вергерон [1964] опубликовал доклад о повторном анализе, эти данные были приняты во внимание при составлении правил подсчета пыльцевых зёрен, описанных ранее. Повторные исследования одного и того же образца мёда, которые были проведены в разных лабораториях, показали высокую степень соответствия. Тем не менее, точность подсчёта и определения пыльцевых зёрен в значительной степени зависит от опыта работы человека, проводящего анализ.
Количественный пыльцевой анализ мёда
Подготовка микропрепаратов из мёда. Мёд растворяют в 40 мл холодной дистиллированной воды и центрифугируют 10 мин. Верхнюю часть надосадочной жидкости аккуратно сливают. Пробирку вновь наполняют дистиллированной водой и снова центрифугируют. Надосадочную жидкость повторно сливают. К осадку доливают 10 мл дистиллированной воды, и помещают пробирку в фильтровальный аппарат. Во время фильтрации в пробирку несколько раз доливают воду. Для получения однородного отложения осадка на фильтре, необходимо соблюдать аккуратность. После фильтр забирают из прибора для просушки. На сухой фильтр наносят иммерсионное масло и помещают его на предметное стекло, затем добавляют сверху ещё 1-2 капли иммерсии.
Подсчёт пыльцевых зёрен. Для получения достоверных данных в микропрепарате необходимо подсчитать не менее 500 пыльцевых зёрен или падевых элементов в 10 трансектах.
Расчёт, представление и интерпретация результатов. Для подсчёта абсолютного числа растительных элементов (N) необходимо предварительно рассчитать площадь поверхности фильтра, содержащей осадок (S) и площадь одного анализируемого в микроскопе поля (s), который измеряют с помощью микрометра. Абсолютное число пыльцевых зёрен в 10 г мёда (PG/10 g) и абсолютное число падевых элементов в 10 г мёда (HDE/10 g) рассчитывают по следующим формулам (I, II):
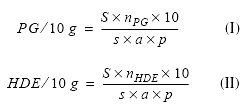 |
где: S – площадь части фильтра, содержащего осадок (мм2); s – площадь одного анализируемого в микроскопе поля (мм2); nPG – общее количество подсчитанных пыльцевых зёрен (PG); nHDE – общее количество подсчитанных падевых элементов (HDE); а – число подсчитанных полей; р – вес мёда (г).
Общее число растительных элементов (N) в 10 г мёда рассчитывают по сумме формул (I) и (II). Результаты выражаются в тысячах с округление до ближайшей тысячи. В зависимости от содержания растительных элементов, меда делят на 5 классов:
Класс I: N < 20 000, включает монофлорные меда с недопредставленной пыльцой.
Класс II: 21 000 < N < 100 000, включает большинство полифлорных медов, падевые и смешанные меда.
Класс III: 101 000 < N < 500 000, включает монофлорные меда с перепредставленной пыльцой и падевые меда.
Класс IV: 501 000 < N < 10 000 000, включает монофлорные меда с перепредставленной пыльцой и некоторые прессованные меда.
Класс V: N > 10 000 000, включает практически только прессованные меда [Von der Ohe, 2004].
Вверх страницы